Visits: 23824
Philipp Wehrli, 2. Januar 2002
Niels Bohrs AtommodellWeshalb fallen die Elektronen eigentlich nicht in den Atomkern? Elektronen kreisen in ungeheurem Tempo um den Atomkern. Eigentlich müssten sie dabei sehr rasch ihre ganze Energie abstrahlen und in den Atomkern hinunter fallen. Dies ist eines der Rätsel, die zur Begründung der Quantentheorie führten. Wie sehr bei vielen Rätseln der Quantentheorie führt uns die Lösung zum Dualismus von Teilchen und Wellen (Sex 1).
Die hier vorgestellte Lösung ist ein letzter Versuch, das Atom (fast) klassisch zu beschreiben. Dass dieser Versuch scheitert, zeigen die Texte Schrödingers Katze und Quanten-Zenon Effekt.
Die Frage, weshalb Elektronen nicht in den Atomkern fallen, tauchte zu Beginn des 20. Jahrhunderts auf. Ernest Rutherford beschoss 1911 eine dünne Goldfolie mit Alpha-Teilchen und schloss aus der Streuung, dass Atome einen schweren, positiv geladenen Kern haben, um den leichte, negativ geladene Teilchen, die Elektronen fliegen, wie die Planeten um die Sonne. Wenn Elektronen in einer Radioantenne beschleunigt werden, strahlen sie elektromagnetische Strahlung ab. Weshalb strahlen die Elektronen bei ihrer Kreisbewegung um die Atomkerne nicht? Berechnungen zeigen, dass die Elektronen in kürzester Zeit ihre gesamte Energie abstrahlen und in den Atomkern hineinfallen sollten.
Niels Bohr stellte die Hypothese auf, dass sich Elektronen nur auf ganz bestimmten Bahnen bewegen können. 1913 fand er eine einfache mathematische Formel, welche diese Bahnen festlegte. Damit war das Problem aber nicht gelöst. Denn weshalb sollten sich Elektronen nur auf bestimmten Bahnen bewegen? Satelliten z. B. können in jedem beliebigen Abstand um die Erde kreisen. Weshalb können Elektronen im Atom dies nicht?
In seiner Doktorarbeit löste Prinz Louis deBroglie das Rätsel mit der Hypothese, die Elektronen seien nicht gewöhnliche Teilchen, sondern sie bewegen sich wellenartig. Energiereiche Elektronen haben eine kurze Wellenlänge, Elektronen mit kleiner Energie eine lange. Ein stillstehendes Elektron hat eine unendlich lange Wellenlänge, (es hat aber eine endliche Frequenz). Weshalb sind Wellen eine Erklärung dafür, dass Elektronen nicht in den Atomkern fallen?
Für alle Materiewellen und auch für Lichtwellen gilt: Je energiereicher, also je schwerer das Teilchen oder das Photon, desto kürzer die Wellenlänge. Im Freien kann die Wellenlänge beliebig lang oder beliebig kurz sein. In einem Atom sind aber nur ganz bestimmte Wellenlängen und damit auch nur ganz bestimmte Energiewerte möglich. Dies sieht man am besten an einer Gitarrensaite. Die Schwingung der Gitarrensaite kann einen, zwei, drei oder unzählige Wellenbuckel haben. Aber nie schwingt sie mit einem halben oder einem Drittel Wellenbuckel. Alle Schwingungen mit einer nichtganzzahligen Anzahl Buckeln löschen sich selbst aus. Die Schwingungen können also so aussehen:
Abblidung 1 Eine Gitarrensaite kann nur so schwingen, dass die Wellenlänge ein Vielfaches der Seitenlänge s ist.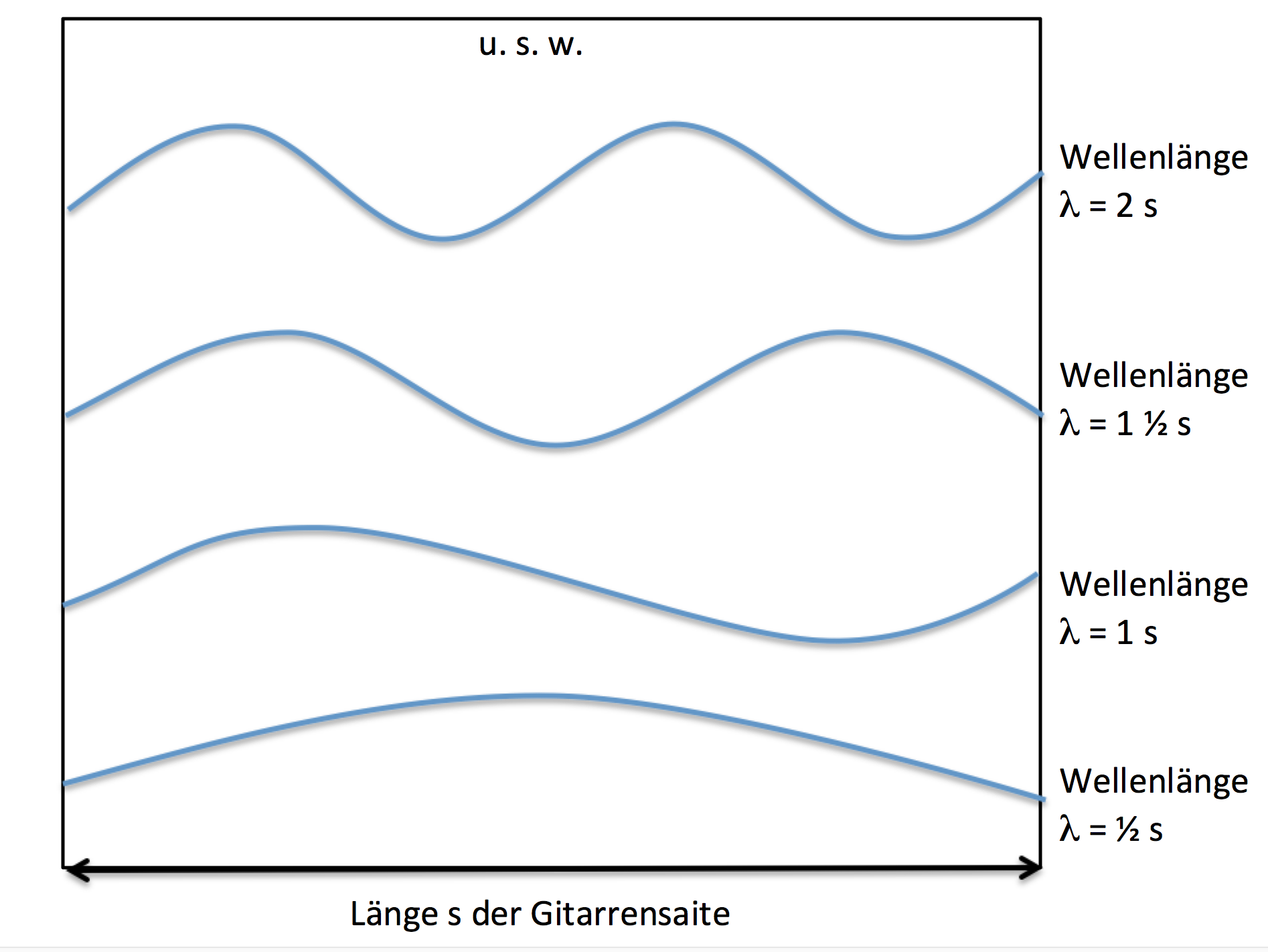
Ein Elektron in einem abgeschlossenen Raum kann nur ganz bestimmte Wellenlängen, also Energien, haben. Eine ganz bestimmte Energie haben, bedeutet für das Elektron, einen ganz bestimmten Abstand vom Atomkern zu haben. Die Bahn des Elektrons um den Atomkern muss gerade das Vielfache einer Wellenlänge sein. Insbesondere kann die halbe Wellenlänge nicht grösser als der Kasten sein. Das heisst, dass das Elektron nicht ruhen kann, denn in Ruhe hätte es eine unendlich lange Wellenlänge. Ein Elektron in einem Kasten muss sich bewegen und so lange es sich bewegt, kann es nicht in den Atomkern fallen.
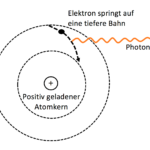
Sendet ein Elektron ein Photon aus, so gibt es Energie ab, sinkt also auf eine Bahn weiter innen. Nimmt es dagegen Energie auf, so steigt es wieder nach aussen. Weil die Energie der Bahnen scharf bestimmt sind, haben auch die ausgesendeten Photonen eine scharfe Wellenlänge, also eine bestimmte Farbe. Die bevorzugt ausgesandten Farben nennt man Spektrallinien. Sie sind bei verschiedenen chemischen Elementen verschieden, und werden dazu verwendet, die chemischen Elemente zu unterscheiden. Zum Beispiel wurde das Element Helium zuerst auf der Sonne entdeckt, als Physiker das Sonnenlicht genau untersuchten.
Abbildung 2
Bohrsches Atommodell. Ein Elektron kann nur auf festen Bahnen (gestrichelte Kreise) um den Atomkern fliegen. Wenn es von einer höheren Bahn auf eine tiefere wechselt, gibt es ein Photon mit einer scharf bestimmten Wellenlänge ab. Nimmt es umgekehrt ein Photon auf, so kann es in eine höhere Bahn springen. Normalerweise sinken alle Elektronen so tief hinunter, wie es nur geht. Allerdings dürfen auf einer Elektronenbahn nur zwei Elektronen sein und diese müssen sich in einer abstrakten Eigenschaft namens ‘Spin’ unterscheiden.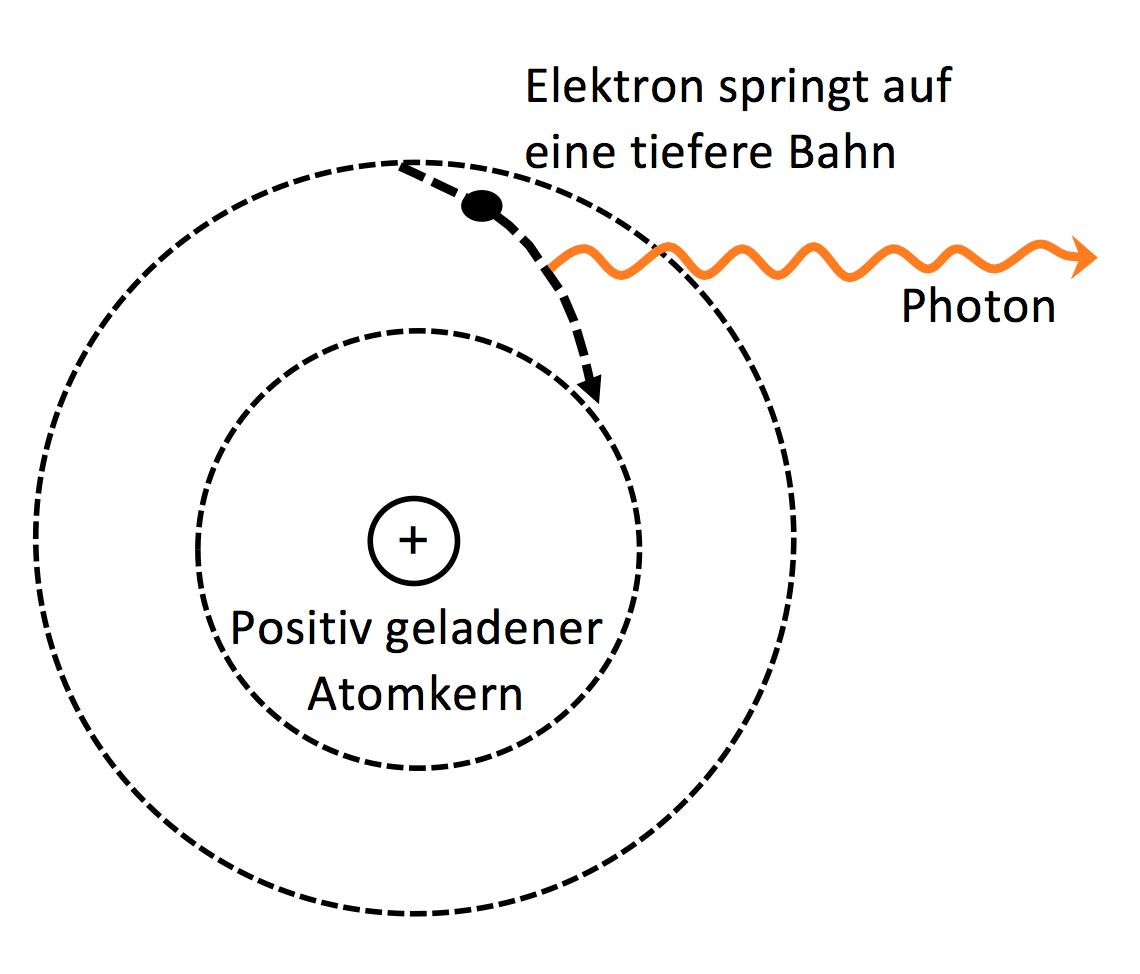
Man darf das Modell von den Elektronenbahnen nicht allzu ernst nehmen. Wo ein Elektron sich befindet, ist wegen der Unbestimmtheitsrelation nicht bestimmt. Das Elektron ist auf verschiedene Bereiche um das Atom herum verschmiert. Diese Bereiche werden Orbitale oder Anregungszustände genannt.
So wie das Atom nur ganz bestimmte Farben abgeben kann, kann es auch nur ganz bestimmte Farben aufnehmen. Je nachdem, mit welchem Licht ein Atom ‘aufgeheizt’ wird, kann es in völlig unterschiedliche Zustände versetzt werden. Raffinierte Varianten solcher Anregungen finden Sie in den Texten Schrödingers Katze und Quanten-Zenon Effekt.
Bohrs Atom ist absolut nichtklassisch
Nach obiger Darstellung könnte man den Eindruck kriegen, Bohrs Atom sei durchaus vereinbar mit der klassischen Physik. Dieser Eindruck wäre völlig falsch, wie Max Planck in seinem Nobel-Vortrag 1920 in Stockholm klarstellte:
“Dass im Atom gewisse, ganz bestimmte quantenmässig ausgezeichnete Bahnen eine besondere Rolle spielen, mochte noch als annehmbar hingenommen werden, weniger leicht schon, dass die in diesen Bahnen mit bestimmter Beschleunigung kreisenden Elektronen gar keine Energie ausstrahlen. Dass aber die ganz scharf ausgeprägte Frequenz eines emittierten Lichtquantums verschieden sein soll von der Frequenz der emittierenden Elektronen, musste von einem Theoretiker, der in der klassischen Schule aufgewachsen ist, im ersten Augenblick als eine ungeheuerliche und für das Vorstellungsvermögen fast unerträgliche Zumutung empfunden werden.” (Gör 1)
Weiterführende Artikel auf dieser Homepage:
Schrödingers Katze
Der Quanten-Zenon Effekt
Externer Link:
Dennoch ist das Bohrsche Atommodell überholt. Eine moderne Sicht, was Atome sind, findet man in den folgenden Büchern.
Weiterführende Bücher
Feynman / Leighton / Sands, ‘Feynman Vorlesungen über Physik, Band III: Quantenmechanik’, (1988), Ouldenbourg, München / Wien
Wer Physik studiert, kennt und schätzt Feynman. Sehr ausführlich, aber auch sehr originell und didaktisch geschickt erklärt der Nobelpreisträger die Quantenmechanik. Das Buch ist das Vorlesungsskript für die Grundvorlesung und setzt demgemäss ein wenig Mathematik voraus. Feynman zeigt, wie man mit Spins rechnet und rechnet das obige Beispiel vor.
Hey Tony / Walters Patrik, (1990), ‘Quantenuniversum’, Spektrum der Wissenschaft, Heidelberg
Keine Entdeckung hat die Geschichte der Menschheit radikaler und rascher verändert als die Quantentheorie. Dies zeigen die Autoren an Hand einer Reihe von Anwendungen allgemeinverständlich und praktisch ohne Formeln. Man kann das 20. Jh. nicht verstehen, wenn man nie von der Quantentheorie gehört hat. Auf Interpretationsfragen wird kaum eingegangen.
Gribbin John, ‘Auf der Suche nach Schrödingers Katze – Quantenphysik und Wirklichkeit’, (1984), R. Piper GmbH & Co. KG, München
Gribbin erzählt die Geschichte der Quantenphysik und schildert, wie ihre Entdecker die neue Physik interpretierten.
Philip Wehrli, ‘Das Universum, das Ich und der liebe Gott’, (2017), Nibe Verlag,

In diesem Buch präsentiere ich einen Gesamtüberblick über mein Weltbild: Wie ist das Universum entstanden? Wie ist das Leben auf der Erde entstanden? Was ist Bewusstsein und woher kommt es? Braucht es dazu einen Gott?
Viele Artikel dieses Blogs werden in diesem Buch in einen einheitlichen Rahmen gebracht, so dass sich ein (ziemlich) vollständiges Weltbild ergibt.
Leserunde bei Lovelybooks zum Buch ‘Das Universum, das Ich und der liebe Gott’, von Philipp Wehrli (abgeschlossen)
Rezensionen bei Lovelybooks
Rezensionen bei Amazon
Film-Präsentation zum Buch
Nibe Verlag